Spasticiteitsbehandeling binnen de verpleeghuissetting
Jorik Nonnekes, Ronald Meijer, Adrie Wolswijk, Hanna van Eijsden, Alexander Geurts
Samenvatting
Verschillende neurologische aandoeningen - zoals CVA, traumatisch hersenletsel, multiple sclerose en dwarslaesie - kunnen leiden tot een beschadiging van de piramidebaan (bovenste motorische neuron). Een beschadiging van dit bovenste motorische neuron resulteert bij een deel van deze patiënten in functioneel hinderlijke spasticiteit. In een recent onderzoek is de prevalentie, impact en behandeling van spasticiteit binnen de verpleeghuissetting in kaart gebracht. Zevenenzeventig patiënten met een beschadiging van de piramidebaan werden geïncludeerd. Bij 56 patiënten (73%) was er sprake van spasticiteit. De spasticiteit belemmerde de zorg bij 71% van de patiënten in hoge mate, en 46% gaf aan krampende pijn te hebben. Een indicatie voor aanvullende spasticiteitbehandeling – bovenop reeds gestarte interventies – was aanwezig bij 36%. Er was dus sprake van onderbehandeling van de spasticiteit. De meest gekozen behandeloptie was intramusculaire injectie van botulinetoxine (10 patiënten). In dit artikel vatten we bovengenoemd onderzoek samen en bespreken we de behandelopties voor spasticiteit aan de hand van de recentelijk gepubliceerde landelijke interdisciplinaire SKMS-richtlijn Cerebrale en/of spinale spasticiteit bij volwassenen. Optimale spasticiteitsbehandeling in het verpleeghuis vereist een goede samenwerking tussen de specialist ouderengeneeskunde, revalidatiearts, paramedici en verplegend personeel.
Introductie
Verschillende neurologische aandoeningen - zoals CVA, traumatisch hersenletsel, multiple sclerose en dwarslaesie - kunnen leiden tot een beschadiging van de piramidebaan (bovenste motorische neuron). Een beschadiging van de piramidebaan resulteert bij een deel van de patiënten, naast een verlies van spierkracht en vermogen om een beweging rond één gewricht uit te voeren zonder dat het hele arm of been in patroon meebeweegt, in spasticiteit (zie box 1). De precieze prevalentie van spasticiteit bij patiënten met een beschadiging van de piramidebaan is onbekend, maar er wordt geschat dat spasticiteit aanwezig is bij ongeveer 40% van alle mensen die een CVA hebben doorgemaakt,1-3 70% van de mensen met een dwarslaesie,4-6 en 80% van de mensen met multiple sclerose.7,8
Box 1: Definitie spasticiteit
Er zijn verschillende definities voor spasticiteit. De meest gebruikte definitie is die van Lance uit 1980: ‘Spasticiteit is een motorische stoornis, gekarakteriseerd door een snelheidsafhankelijke toename van de tonische strekreflexen (spiertonus) met verhoogde peesreflexen, op basis van verhoogde prikkelbaarheid van de strekreflex, als één van de uitingen van een laesie van de piramidebaan’.9
In 2005 stelde de Europese spasticiteitwerkgroep (SPASM) voor om spasticiteit te definiëren als ‘Een verstoorde senso-motore regulatie als gevolg van een beschadiging van de piramidebaan, die zich manifesteert als intermitterende of aanhoudende onwillekeurige spieractivatie’.10
Het is belangrijk om spasticiteit te onderscheiden van ‘rigiditeit’ en ‘dystonie’, die beide gezien worden bij extrapiramidale aandoeningen. Bij dystonie is er sprake van een aanhoudende onwillekeurige spieractiviteit, maar deze is nooit snelheidsafhankelijk. Daarnaast neemt dystonie vaak toe bij correctie van de standsafwijkingen. Bij rigiditeit wordt er een tandradfenomeen gevoeld over het hele bewegingstraject, en is er geen snelheidsafhankelijke component.
Spasticiteit is niet altijd een probleem; een deel van de patiënten maakt gebruik van spasticiteit tijdens dagelijkse activiteiten, zoals bij het maken van een transfer en bij het lopen. Deze voordelen worden vooral gezien bij mensen met een ernstige beschadiging van de piramidebaan in het ruggenmerg, zoals kan voorkomen bij mensen met een dwarslaesie of multiple sclerose. Spasticiteit leidt echter vaker tot negatieve gevolgen, zoals pijnklachten, verminderde bewegingssturing, fysiek ongemak, decubitus door een veranderde houding en smetplekken vanwege moeizame verzorgbaarheid. In deze gevallen moet behandeling overwogen worden. De revalidatiearts is specialist op het gebied van spasticiteitsbehandeling. Mensen die revalideren binnen de medisch specialistische revalidatie worden frequent door de revalidatiearts gezien, en bij deze groep wordt regelmatig een behandeling overwogen en gestart. Een deel van de mensen met een beschadiging van de piramidebaan verblijft echter in een verpleeghuis. Dit betreft met name de oudere patiënt, maar steeds vaker ook een relatief jonge ernstig aangedane populatie.11 Het is dan ook te verwachten dat bij deze groep spasticiteit veelvuldig voorkomt. De prevalentie, impact en behandeling van spasticiteit binnen de verpleeghuissetting was echter tot voor kort nauwelijks in kaart gebracht. In een recent onderzoek door Meijer en collega’s is hiertoe een aanzet gedaan.12 Hier vatten we dit onderzoek samen en bespreken we de behandelopties voor spasticiteit, waarbij we gebruik maken van de recentelijk gepubliceerde landelijke interdisciplinaire SKMS-richtlijn Cerebrale en/of spinale spasticiteit bij volwassenen.13
Prevalentie en impact
Methode
De studie van Meijer en collega’s vond plaats in drie verpleeghuizen in de regio Arnhem. Gedurende 14 maanden werden alle patiënten met een beschadiging van de piramidebaan die verbleven op een revalidatie- of somatische afdeling gevraagd om deel te nemen aan het onderzoek. Indien patiënten zelf geen toestemming konden geven, werd een familielid gevraagd. Mensen met een dusdanige conditie waarin spasticiteitsbehandeling geen prioriteit had of niet mogelijk was, werden uitgesloten.
Geschikte deelnemers werden middels neurologisch onderzoek onderzocht op de aanwezigheid en ernst van spasticiteit. Spasticiteit werd vastgelegd met onder andere de Modified Ashworth Scale, die een ruwe score voor de spiertonus oplevert. Tevens werd er gekeken naar de aanwezigheid van pathologische reflexen en de aanwezigheid van myogene contractuurvorming (verminderde beweeglijkheid in het gewricht door verkorting van het spier/peescomplex). Tenslotte werd de functionele impact van spasticiteit nagevraagd en werd door de revalidatiearts geëvalueerd of de aanwezige spasticiteit nadere behandeling behoefde.
Resultaten
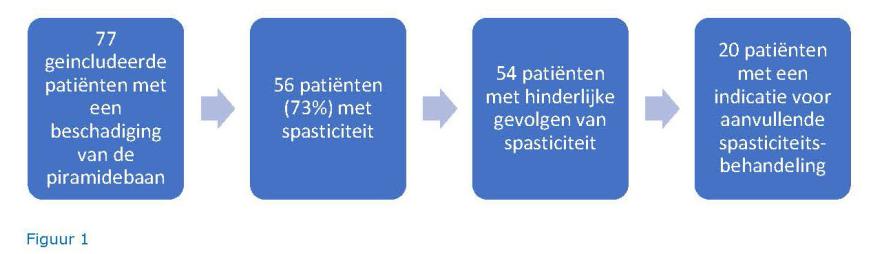
In de drie verpleeghuizen waren gedurende de studieperiode 280 mensen opgenomen op de afdeling somatiek en revalidatie, waarvan 160 mensen een beschadiging van de piramidebaan hadden. Van deze 160 mensen konden er uiteindelijk 77 deelnemers geïncludeerd worden. De belangrijkste exclusieredenen was het feit dat patiënt of familieleden geen toestemming voor deelname wilden geven of de patiënt had een dusdanige conditie waardoor spasticiteitbehandeling niet de prioriteit had, bijvoorbeeld omdat de patiënt terminaal was. Bij 56 van de 77 geïncludeerde patiënten (73%) was er sprake van spasticiteit (zie figuur 1). Bij alle mensen met spasticiteit was er sprake van een verhoogde score op de Modified Ashworth Scale in één of meerdere spiergroepen, waarbij de armen en benen gelijk verdeeld waren. Bij 38 patiënten (49%) was er tevens sprake van pathologisch verhoogde reflexen, en 45 deelnemers (58%) hadden één of meerdere contracturen.
CVA was de meest frequente diagnose (41 mensen) en hier was bij 73% van de patiënten sprake van spasticiteit. Spasticiteit kwam vaker voor bij mensen die op een somatische verblijfsplek verbleven (42/56) dan bij patiënten op een geriatrische revalidatieafdeling (14/21).
Twee patiënten hadden functionele winst door de aanwezige spasticiteit. Het merendeel van de mensen met spasticiteit ervoer echter negatieve gevolgen. Bij 71% van de mensen met spasticiteit vormde de verhoogde spiertonus een hoge belemmering bij de zorg. Bij 46% van de mensen met spasticiteit was er sprake van pijnlijke krampen, bij 20% waren er cosmetische problemen en bij 26% waren er overige nadelige gevolgen zoals problemen bij het maken van een transfer of bij het lopen. De revalidatiearts indiceerde een aanvullende spasticiteitbehandeling bij 20 patiënten (36%). Vaak was er meer dan één behandeldoel. Het doel van de behandeling was bij 3 patiënten functionele verbetering, bij 12 patiënten een betere verzorgbaarheid, bij 12 deelnemers een reductie van pijnlijke spasmen, bij 1 patiënt een verbetering van de nachtrust en bij 2 mensen een verbetering van cosmetiek.
Behandelopties kwamen in combinatie voor: de meest gekozen behandeloptie was intramusculaire injectie van botulinetoxine (10 patiënten), gevolgd door orale spasmolytica (8 patiënten), fenolisatie van een perifere zenuw (2 patiënten), orthesiologie (2 patiënten) en oefentherapie (2 patiënten). Chirurgische interventies werden niet geadviseerd, omdat dit een eerste consultatie betrof.
Discussie
Bovenstaande studie laat zien dat spasticiteit een veelvoorkomend fenomeen is in de verpleeghuissetting bij mensen met een beschadiging van de piramidebaan. De prevalentie van spasticiteit bij patiënten met een CVA imponeert in de verpleeghuissetting hoger te zijn dan in de bredere populatie (77% versus 40%).1-3 Dit kan worden verklaard doordat mensen in een verpleeghuis vaak een relatief ernstige verlamming hebben. De ernst van de verlamming is namelijk de belangrijkste predictor van het optreden van spasticiteit na CVA. Bij een aanzienlijk deel van de mensen met spasticiteit die in het verpleeghuis verblijft is er derhalve een indicatie voor aanvullende spasticiteitbehandeling.
Behandeling
Hieronder lichten we de behandeling van spasticiteit kort toe,11 waarbij we gebruik maken van de recent gepubliceerde landelijke interdisciplinaire SKMS-richtlijn voor Cerebrale en/of spinale spasticiteit bij volwassenen.13 Spasticiteit behoeft niet altijd behandeling, maar behandeling dient overwogen te worden zodra spasticiteit hinderlijk aanwezig is. In alle gevallen van hinderlijke spasticiteit is onderzoek en mogelijke behandeling van spasticiteit-uitlokkende factoren geïndiceerd. Spasticiteit-uitlokkende prikkels komen vaak voort vanuit de huid (bijvoorbeeld een ingegroeide teennagel of knellende kleding), het bewegingsapparaat (bijvoorbeeld een pijnlijke schouder), de blaas (bijvoorbeeld een retentieblaas) of de darm (bijvoorbeeld obstipatie). Deze prikkels leiden bij de algehele populatie slechts tot ongemak, maar kunnen – vooral bij mensen met spinale beschadiging van de piramidebaan – tot een toename van spasticiteit leiden en dienen dan ook zo goed mogelijk behandeld te worden.
Als er geen uitlokkende prikkels zijn of als deze niet voldoende kunnen worden weggenomen, moet spasticiteitsbehandeling overwogen worden. Het doel van de behandeling moet nauwkeurig omschreven worden, zodat dit voor patiënt, familieleden en betrokken zorgverleners helder is, en zodat het effect van de behandeling geëvalueerd kan worden. Bij mensen die verblijven op de somatische afdeling van een verpleeghuis zal de behandeling vaak gericht zijn op verbetering van comfort en verzorgbaarheid. Bij mensen binnen de medisch-specialistische revalidatie en GRZ zullen naast een verbetering van houding en comfort ook vaak functionele doelen (zoals verbetering van ADL-vaardigheid, balans- of loopvaardigheid) gesteld worden.
De keuze van de behandelmethode hangt vervolgens ten dele af van de verdeling van spasticiteit over het lichaam. Orale spasmolytica kunnen overwogen worden bij hinderlijke gegeneraliseerde spasticiteit, dat wil zeggen uitgebreide spasticiteit in meerdere spiergroepen, vaak in beide benen of in alle extremiteiten. Bij mensen met cognitieve stoornissen dient men terughoudend te zijn met orale spasmolytica, omdat deze centraal aangrijpen. Baclofen en tolperison hebben het meest gunstige bijwerkingenprofiel. Bij patiënten met gegeneraliseerde spasticiteit in de onderste en/of bovenste extremiteit die onvoldoende reageren op orale spasmolytica kan behandeling met intrathecale baclofen (‘baclofenpomp’) overwogen worden. Vanwege de bloed-hersenbarrière worden na orale toediening van baclofen relatief lage liquorconcentraties bereikt, waardoor de behandeling bij matige tot ernstige spasticiteit onvoldoende kan zijn. Door intrathecale toediening van baclofen worden gemakkelijker de juiste liquorconcentraties bereikt, en komen bijwerkingen vanwege de lagere systemische doseringen minder vaak voor. De intrathecale baclofenpomp moet in een gespecialiseerd centrum worden geïmplanteerd, maar bijvullingen van de pomp worden zo veel mogelijk in het verpleeghuis gedaan (dit is mogelijk via de organisatie care4homecare; www.care4homecare.org).
Bij focale en regionale spasticiteit, dat wil zeggen hinderlijke spasticiteit in een beperkt aantal spiergroepen, zijn intramusculaire botulinetoxine injecties of eventueel lokale zenuwblokkade middels chemische neurolyse eerste keus. Intramusculaire toediening van botulinetoxine remt presynaptisch het vrijkomen van acetylcholine ter hoogte van de neuromusculaire overgang en veroorzaakt daardoor een verminderde prikkelbaarheid van de spier, wat resulteert in een tonusafname van de behandelde spier. Bij chemische neurolyse door fenol wordt het zenuwsignaal door de toxische werking van de fenol op de zenuw gedeeltelijk onderbroken. Beide behandelopties vinden bij voorkeur onder echogeleide en/of elektrostimulatie plaats om de kans op complicaties zoals intravasale toediening, of injectie in de verkeerde spier, zo klein mogelijk te krijgen. Door de beschikbaarheid van mobiele apparatuur is het goed mogelijk om focale spasmolyse in het verpleeghuis toe te passen.
In de verpleeghuissetting heeft focale behandeling met intramusculaire toediening van botulinetoxine meestal de voorkeur boven chemische neurolyse met fenol, omdat neuropathische pijnklachten een bijwerking kunnen zijn van fenol. Een voorbeeld van een mogelijke indicatie voor behandeling met intramusculaire botulinetoxine is het verminderen van kuitspierspasticiteit die aanleiding geeft tot een hinderlijke spitsstand van de voet tijdens het lopen. Een ander voorbeeld is het verminderen van spasticiteit in de pectoralis major en de elleboogflexoren die leidt tot een hinderlijke adductie-, endorotatie- en flexiestand van de arm, resulterend in een moeizame verzorgbaarheid. Hoewel intramusculaire toediening van botulinetoxine meestal de voorkeur heeft boven chemische neurolyse, kan bij patiënten met hinderlijke schaarspasmen (en dientengevolge verzorgingsproblematiek en/of een zeer smalle basis tijdens staan en lopen), fenolisatie van de nervus obturatorius overwogen worden. Dit kan ook worden overwogen om te voorkómen dat de maximaal toegestane dosering van botulinetoxine wordt overschreden, indien diverse spiergroepen tegelijkertijd moeten worden behandeld. De nervus obturatorius innerveert sensibel slechts een relatief klein gebied aan de mediale zijde van het bovenbeen. Hierdoor is het risico op hinderlijke neuropathie klein.
Zowel intramusculaire botulinetoxine injecties als chemische neurolyse moeten in principe samen gaan met actieve of passieve oefentherapie gericht op spierrekking, en eventueel het gebruik van orthesen, om het effect van de neuro(musculaire) blokkade te ondersteunen en te verlengen. Bij focale spasmolyse wordt gestreefd naar zo lang mogelijke intervallen. Er kan in principe zeer langdurig worden behandeld, maar in dat geval moet ook worden gedacht aan alternatieve opties.
Bij herhaalde intramusculaire toediening van botulinetoxine moeten als alternatief ook chirurgische interventies (zoals een tenotomie, peesverlenging of zelfs arthrodese) overwogen worden. In de verpleeghuissetting kan een tenotomie van de polsflexoren bijvoorbeeld pijn en spanning verminderen en bijdragen aan een betere verzorgbaarheid. In geselecteerde casus kan men ook direct voor een dergelijke chirurgische behandeling kiezen.
Conclusie
Hinderlijke spasticiteit komt veel voor binnen de verpleeghuissetting, en momenteel lijkt er sprake te zijn van onderbehandeling. Herkenning van hinderlijke spasticiteit is een belangrijke eerste stap om onderbehandeling te voorkomen. Optimale behandeling vereist vervolgens een goede samenwerking tussen de specialist ouderengeneeskunde, revalidatiearts, paramedici en verplegend personeel. Door in de vroege fase te anticiperen en de revalidatiearts te consulteren, kunnen complicaties zoals contracturen, pijn, decubitus of smetplekken worden voorkómen, wat bijdraagt aan optimaal comfort en kwaliteit van leven voor de patiënt.
Belangenverstrengeling
De auteurs hebben geen belangenverstrengeling. Het schrijven van dit artikel is mede mogelijk gemaakt door een financiële bijdrage van Ipsen Pharmaceuticals.
Auteur(s)
- Dr. Jorik Nonnekes, revalidatiearts i.o., Donders Institute for Brain, Cognition and Behaviour, Radboud Universiteit Medisch Centrum, afdeling revalidatie, Nijmegen
- Dr. Ronald Meijer, revalidatiearts, Revalidatiecentrum Klimmendaal, Arnhem
- Drs. Adrie H.M. Wolswijk, revalidatiearts, RevaZorg, locaties Arnhem en Apeldoorn
- Hanna van Eijsden, fysiotherapeut, Gelre Ziekenhuizen, afdeling fysiotherapie, Apeldoorn
- Prof. dr. Alexander C.H. Geurts, hoogleraar revalidatiegeneeskunde, Donders Institute for Brain, Cognition and Behaviour, Radboud Universiteit Medisch Centrum, afdeling revalidatie, Nijmegen
Literatuur
- Martin A, Abogunrin S, Kurth H, Dinet J. Epidemiological, humanistic, and economic burden of illness of lower limb spasticity in adults: a systematic review. Neuropsychiatr Dis Treat 2014; 10: 111-22.
- Opheim A, Danielsson A, Alt Murphy M, Persson HC, Sunnerhagen KS. Upper-limb spasticity during the first year after stroke: stroke arm longitudinal study at the University of Gothenburg. American journal of physical medicine & rehabilitation 2014; 93(10): 884-96.
- Wissel J, Manack A, Brainin M. Toward an epidemiology of poststroke spasticity. Neurology 2013; 80(3 Suppl 2): S13-9.
- Maynard FM, Karunas RS, Waring WP, 3rd. Epidemiology of spasticity following traumatic spinal cord injury. Archives of physical medicine and rehabilitation 1990; 71(8): 566-9.
- Noreau L, Proulx P, Gagnon L, Drolet M, Laramee MT. Secondary impairments after spinal cord injury: a population-based study. American journal of physical medicine & rehabilitation 2000; 79(6): 526-35.
- Skold C, Levi R, Seiger A. Spasticity after traumatic spinal cord injury: nature, severity, and location. Archives of physical medicine and rehabilitation 1999; 80(12): 1548-57.
- Goodin DS. Survey of multiple sclerosis in northern California. Northern California MS Study Group. Multiple sclerosis 1999; 5(2): 78-88.
- Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by multiple sclerosis patients. Multiple sclerosis 2004; 10(5): 589-95
- Lance JW. The control of muscle tone, reflexes, and movement: Robert Wartenberg Lecture. Neurology 1980; 30(12): 1303-13.
- Pandyan AD, Gregoric M, Barnes MP, et al. Spasticity: clinical perceptions, neurological realities and meaningful measurement. Disability and rehabilitation 2005; 27(1-2): 2-6.
- Wolswijk AH, Dirkx AE. [Treatment of spasticity in nursing homes: botulinum toxin type A as part of therapy]. Nederlands tijdschrift voor geneeskunde 2015; 159: A7833.
- Meijer R, Wolswijk A, van Eijsden H. Prevalence, impact and treatment of spasticity in nursing home patients with central nervous system disorders: a cross-sectional study. Disability and rehabilitation 2017; 39(4): 363-71.
- Richtlijn Behandeling van cerebrale en/of spinale spasticiteit bij volwassenen 2017. https://richtlijnendatabase.nl/richtlijn/cerebrale_en_of_spinale_spasticiteit/cerebrale_en_of_spinale_spasticiteit_-_startpagina.html

