Medicatieveiligheidsscreening medicatiegebruik
Bij kwetsbare ouderen van de huisartsenpopulatie
Ineke Bos, Drs. Wanda Rietkerk, Drs. Adriaan R.W. Barentsen, Prof. dr. Sytse U. Zuidema
In dit artikel wordt het onderzoek naar de gevolgen van medicatieveiligheidsscreening op medicatiegebruik bij kwetsbare ouderen besproken. Tevens worden de gevolgen beschreven bij het bepalen welke subgroepen van ouderen bij de medicatieveiligheidsscreening de meeste adviezen worden gegeven.
Samenvatting
Doel
Gevolgen beschrijven van medicatieveiligheidsscreening op medicatiegebruik bij kwetsbare ouderen en bepalen bij welke subgroepen van ouderen bij de medicatieveiligheidsscreening de meeste adviezen worden gegeven.
Methode
Een multidomein assessment en medicatieveiligheidsscreening (farmacotherapeutische anamnese en analyse waarbij farmacotherapeutische problemen worden gesignaleerd) werden aangeboden aan kwetsbare ouderen in de huisartsenpraktijk. Na het assessment ontving de huisarts adviezen. Het aantal verstrekte adviezen bij de medicatieveiligheidsscreening en het aantal daarvan doorgevoerde adviezen (binnen zes maanden) werd bepaald. Met logistische regressie werd bepaald welke (combinatie van) variabelen samenhingen met het al dan niet verstrekken van adviezen.
Resultaten
Bij 192 ouderen werden 360 adviezen gegeven. Van 262 adviezen was te verifiëren of ze waren doorgevoerd. Dit bleek bij 31% (81) te zijn gebeurd. Alleen de variabele ‘aantal geneesmiddelen’ bleek significant voorspellend voor het verstrekken van één of meerdere adviezen tijdens de medicatieveiligheidsscreening met als meest ideale afkappunt vier geneesmiddelen of meer.
Conclusie
Bij ouderen die meer dan drie geneesmiddelen slikten werden na een medicatieanamnese en medicatie-analyse de meeste farmacotherapeutische adviezen gegeven. Na zes maanden was een derde van deze adviezen opgevolgd. Gegeven het feit dat twee derde van adviezen niet wordt opgevolgd, lijkt het zeker van belang voortdurend afstemming tussen apotheker, huisarts en oudere te realiseren teneinde het aantal farmacotherapeutische problemen te verminderen.
Door de dubbele vergrijzing neemt het aantal kwetsbare ouderen met meerdere en complexe zorgproblemen toe. Deze ouderen hebben vaak multimorbiditeit en polyfarmacie. Van de mensen ouder dan 65 jaar gebruikt de helft meer dan vijf geneesmiddelen.1 Dit is een risicofactor voor potentieel vermijdbare ziekenhuisopnames, bijvoorbeeld ten gevolge van verstoorde elektrolyten, gastro-intestinale klachten of collaps.2 Medicijngebruik onder kwetsbare ouderen is dus niet optimaal en zou verbeterd moeten worden. Een manier om farmacotherapeutische gerelateerde problemen (FTP’s) in kaart te brengen en te verminderen is het gebruik van een medicatiereview.
Onderzoeken hiernaar bij ouderen in de huisartsenpraktijk laten wisselende uitkomsten zien. Gunstige effecten werden gezien op afname van polyfarmacie3-8 vermindering van het aantal FTP’s7 en vermindering van het aantal contacten met de afdeling spoedeisende hulp.9 Ook lijkt de medicatiereview kosteneffectief.5 In de literatuur zijn tot op heden voornamelijk mensen geselecteerd voor een review op basis van leeftijd,3,5,7,8,10-13 multimorbiditeit,11 polyfarmacie7,8,10-13 of geneesmiddelengebruik per groep.12
Teveel medicijngebruik onder kwetsbare ouderen leidt dus tot gezondheidsrisico’s en het middel medicatiereview zou eraan kunnen bijdragen om dit medicijngebruik te verbeteren. Het is echter wel nodig dit zo efficiënt mogelijk te doen. Een medicatiebeoordeling kan op verschillende manieren plaatsvinden. Een volledig medicatiereview is tijdrovend en omvat onder andere een medicatieanamnese en risico-analyse. Het is niet bekend wat de effecten van deze afzonderlijke componenten zijn. Daarnaast is het zinnig vooraf subgroepen te identificeren om een medicatiereview zo efficiënt mogelijk in te zetten. Er lijkt niet eerder een onderzoek gedaan te zijn naar selectiecriteria in een populatie zonder voorselectie op het aantal geneesmiddelen.
Het doel van dit onderzoek is daarom tweeledig:
- meer inzicht te krijgen in het proces van een medicatieanamnese en risicoanalyse door het bepalen van het aantal gegeven adviezen per oudere en het percentage adviezen dat binnen zes maanden wordt opgevolgd en
- met welke variabele een subgroep van ouderen te identificeren is waarbij de meeste adviezen gegeven worden.
Methode
Studie opzet
De gegevens voor dit deelonderzoek zijn verzameld in de interventie Wijs Grijs. Dit is een project opgezet om huisartsen te ondersteunen in de ouderenzorg (it Dok te Drachten).14Het onderzoek is een quasi-experimenteel onderzoek naar de effecten van een uitgebreid multidisciplinair geriatrisch assessment (comprehensive geriatric assessment (CGA)) uitgevoerd door een verpleegkundige of specialist ouderengeneeskunde (bij hogere kwetsbaarheid). Dit onderzoek wordt aangevuld met een consult door een mondhygiëniste en apotheker (de medicatieveiligheidsscreening (MVS)), waarna adviezen ter verbetering van welzijn en gezondheid worden gegeven aan de oudere (mondeling) en huisarts (schriftelijk).
Van de deelnemende 65-plussers uit vier huisartsenpraktijken in (de omgeving van) Drachten, werden de kwetsbaarheid (Groninger Frailty Indicator (GFI)15,16 en zorgcomplexiteit (Intermed)17 bepaald. Op basis van de hoogte van deze scores werd een oudere in één van de vijf zorgprofielen ingedeeld.18 Zorgprofiel 1 omvat vitale ouderen, zorgprofiel 2 ouderen met psychosociale en/of coping problemen, zorgprofiel 3 ouderen met lichamelijke mobiliteitsproblemen, zorgprofiel 4 ouderen met multidomein problemen en zorgprofiel 5 omvat ouderen die extreem kwetsbaar zijn en waarbij vaak ook sprake is van een palliatieve zorgvraag.
Alle kwetsbare ouderen die voldeden aan de inclusiecriteria GFI ≥4 en/of een zorgprofiel ≥2, werden uitgenodigd voor het assessment van Wijs Grijs. Het hier beschreven deelonderzoek richt zich op het deel van de interventie dat uitgevoerd wordt door de apotheker (MVS). Voor dit deelonderzoek werden data gebruikt die verzameld worden sinds de start van de interventie op 1 januari 2013 tot 18 april 2014. Alle ouderen gaven toestemming voor deelname aan wetenschappelijk onderzoek na informed consent. Het onderzoek werd door de METC als niet-WMO-plichtig beschouwd, omdat het binnen de standaard verbetering en evaluatie van de zorg valt.
Interventie: medicatieveiligheidsscreening
Voorafgaand aan de interventie werd het actuele medicatieoverzicht van elke oudere uit het apotheek informatiesysteem (Pharmacom) opgevraagd. Via de huisarts werden de actuele episodelijst, medicatielijst en recente laboratoriumbepalingen (inclusief nierfunctie eGFR volgens MDRD – indien bekend) verkregen. Met behulp van de bovenstaande verzamelde informatie vond een farmacotherapeutische analyse plaats door een apotheker op basis van START/STOPP criteria en STRIP.19 Hierna volgde een gesprek met de oudere door middel van een gestructureerde medicatieanamnese (GMA) vragenlijst. Dit gesprek werd gevoerd door de apotheker als de oudere voor het CGA naar het centrum van het onderzoek kwam. Vond het CGA plaats als huisbezoek (op verzoek van de oudere) of in de huisartsenpraktijk dan werd dit medicatiegesprek aansluitend aan het CGA gevoerd door de verpleegkundige (zorgprofiel 1,2,3) of specialist ouderengeneeskunde (zorgprofiel 4 en 5). De bevindingen werden door de apotheker samengevoegd met de medicatie-analyse. De gevonden FTP’s werden omgezet in medicatieadviezen. De bevindingen uit het CGA werden samen met de adviezen uit de MVS in een brief naar de betreffende huisarts gestuurd.
Afhankelijke variabele – aantal (doorgevoerde) adviezen
Per oudere werd door de apotheker gerapporteerd welk type en aantal adviezen deze oudere had gekregen na de MVS. De adviezen werden in de volgende categorieën ingedeeld: medicatie toevoegen, medicatie vervangen, medicatie stoppen, medicatie afbouwen, wijziging toedieningsvorm, dosering verhogen, dosering verlagen, gebruik tijd wijzigen, economische substitutie (advies om goedkoper middel te gebruiken), therapie(on)trouw, medisch hulpmiddel (bijvoorbeeld medicijnrol of incontinentiemateriaal), instructie oog/longen (bijvoorbeeld inhalatie- of druppelinstructie), lab bekijken (laboratoriumwaarde opvragen of bepalen). Zes maanden na de MVS werd in Pharmacom gecontroleerd of er verschillen werden gezien met de medicatielijst vòòr de MVS en of die verschillen pasten bij de gegeven adviezen.
Op basis van de medicatielijst was het niet te verifiëren of de gegeven adviezen, ten aanzien van inname van medicatie, om therapie(on)trouw te verbeteren en naar aanleiding van labwaarden of ze waren doorgevoerd. De medicatielijst werd daarom niet opgenomen in verdere analyses. Het advies instructie oog/longen werd direct tijdens de MVS gegeven en doorgevoerd en werd niet verder onderzocht.
Onafhankelijke variabelen
Vooraf werden relevante onafhankelijke variabelen vastgesteld. Uit het hierboven beschreven triage-instrument werden leeftijd, aantal aandoeningen, GFI, zorgprofiel en Intermed verzameld en uit het huisartsendossier de ‘nierfunctie’ (eGFR ml/min). Op basis van de medicatielijst uit Pharmacom werden daarnaast nog de volgende variabelen bepaald: het aantal geneesmiddelen, het aantal groepen geneesmiddelen (cardiovasculair, diabetes, antistolling, neurologie/psychiatrie (onderhoudsbehandeling met antidepressiva, anti-epileptica, anti-parkinsonmiddelen), astma/COPD, NSAID’s/opioïden) en het aantal geneesmiddelen met smalle therapeutische breedte (acenocoumarol, anti-epileptica, digoxine, lithium, gentamicine en levothyroxine).
Statistische analyse
Vervolgens werd, per oudere, per huisartsenpraktijk en per categorie adviezen, het percentage berekend van het aantal doorgevoerde adviezen. Met logistische regressie werd bepaald welke (combinatie van) variabele(n) het beste voorspellend was/waren voor het al dan niet geven van adviezen.
Alleen die variabelen die qua gemiddelde (SD) voldoende (p-waarde < 0,2) verschilde tussen de groepen, met en zonder advies, werden in het multivariaat logistisch regressie (begin)model opgenomen. Na de handmatige backward procedure bleven alleen de variabelen over met p-waarde < 0,05 (gekozen significantieniveau). Het meest ideale afkappunt werd bepaald door middel van de ROC-curve (met optimale verhouding van de sensitiviteit en specificiteit). Alle analyses werden uitgevoerd met behulp van SPSS versie 20.
Resultaten
Voor deelname aan het assessment werden 1.635 65-plussers uit vier huisartspraktijken uitgenodigd. Hiervan ondergingen er 297 het volledige assessment. Van 192 ouderen konden de gegevens worden geanalyseerd (zie figuur 1).
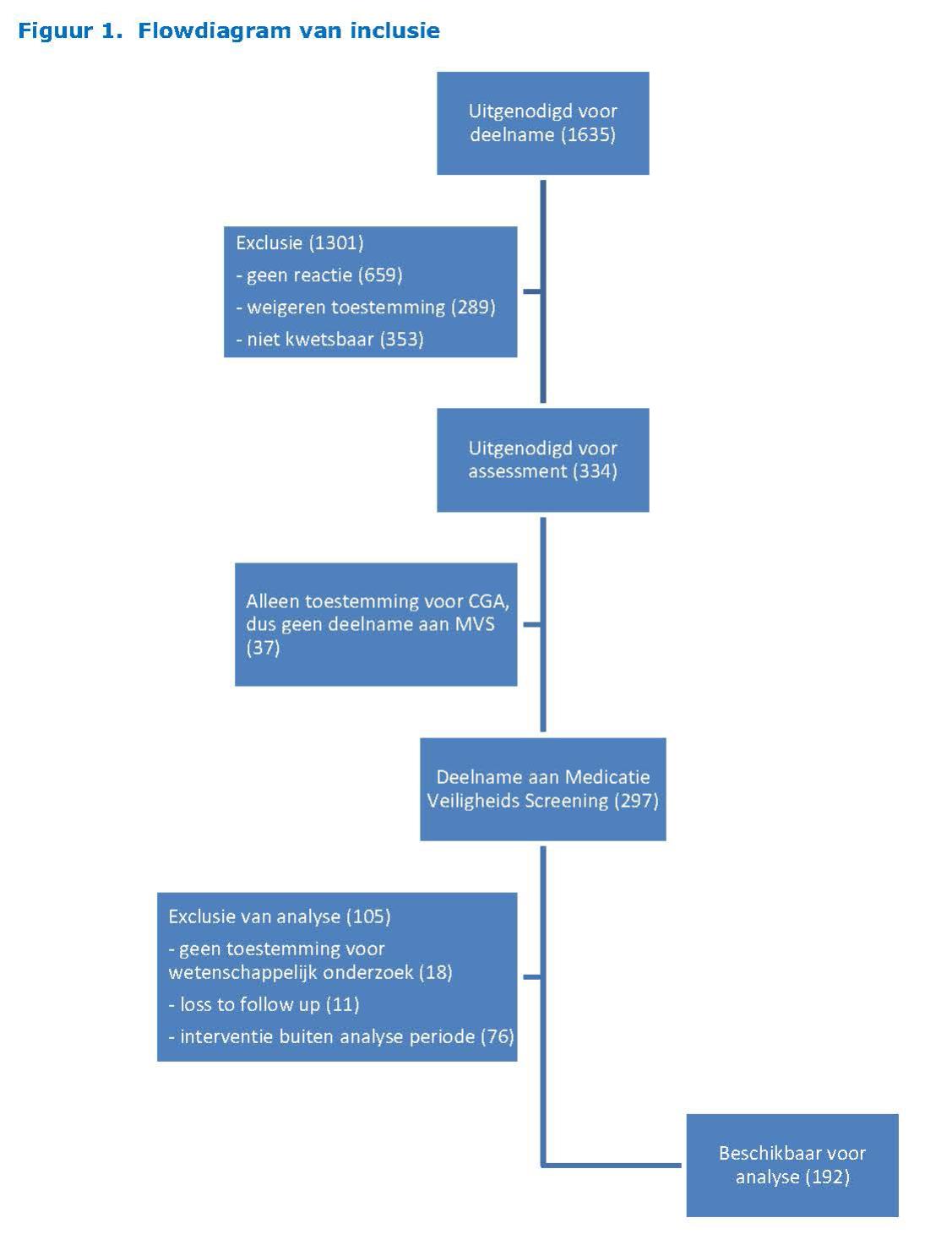
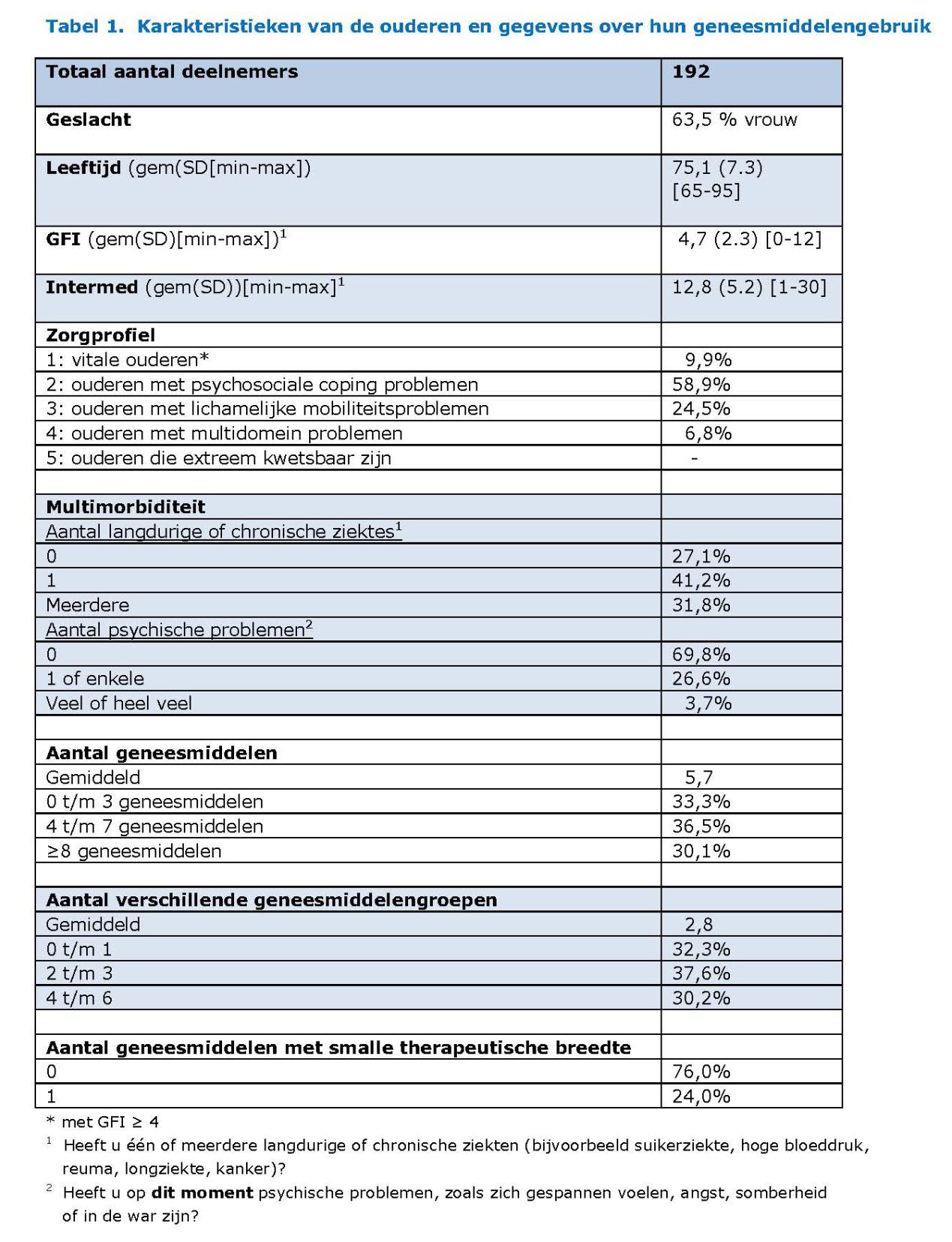
Bijna twee derde van de ouderen was vrouw en de gemiddelde leeftijd was 75 jaar (zie tabel 1). Van hen had 70% één of meerdere langdurige of chronische ziekten en 30% gebruikte acht geneesmiddelen of meer. Omdat het slikken van medicatie geen selectiecriterium was voor het MVS, zijn er ook ouderen geïncludeerd die geen enkel geneesmiddel gebruikten.
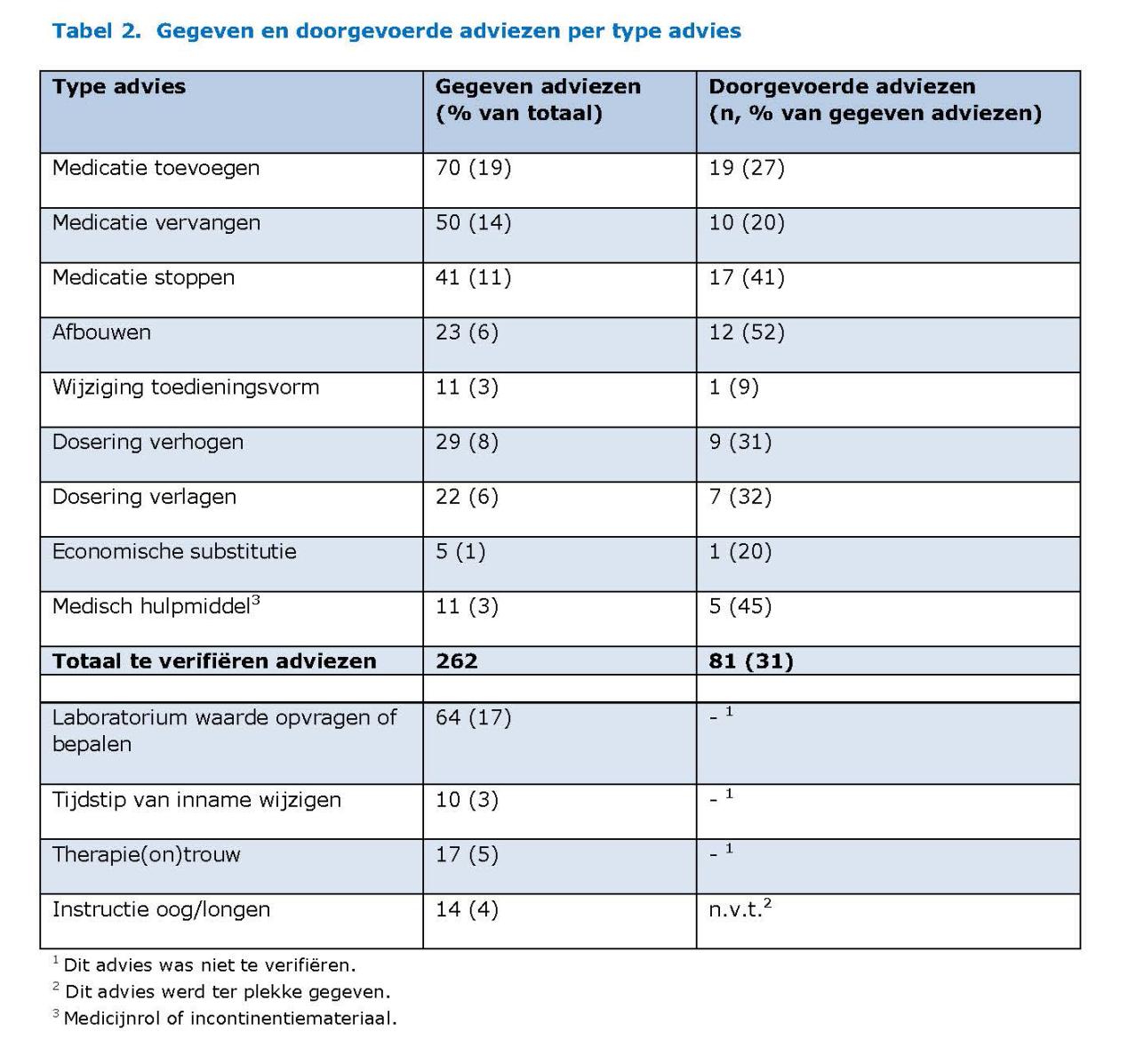
Van de 192 ouderen gaf bij 37 (19,3%) de medicatiescreening geen reden tot advies. Van de 155 ouderen die minstens één advies hadden gekregen, is bij 38,1% minstens één advies doorgevoerd (zie tabel 2). In totaal zijn er 360 adviezen gegeven en zijn 81 van de 262 te verifiëren adviezen (31%) doorgevoerd. De adviezen die het meest werden gegeven, waren: medicatie toevoegen, medicatie vervangen en laboratoriumwaarde opvragen of bepalen. De adviezen die relatief het meest werden doorgevoerd, waren medicatie afbouwen, medicatie stoppen en medisch hulpmiddel inzetten. Er is een grote spreiding tussen de doorgevoerde adviezen per huisartspraktijk, waarbij de praktijken die een directe samenwerking hadden met de onderzochte apotheek meer adviezen doorvoerden dan de praktijken die zelf apotheekhoudend waren (resp. 5,8% en 11,1% versus 25,5% en 39,1%).
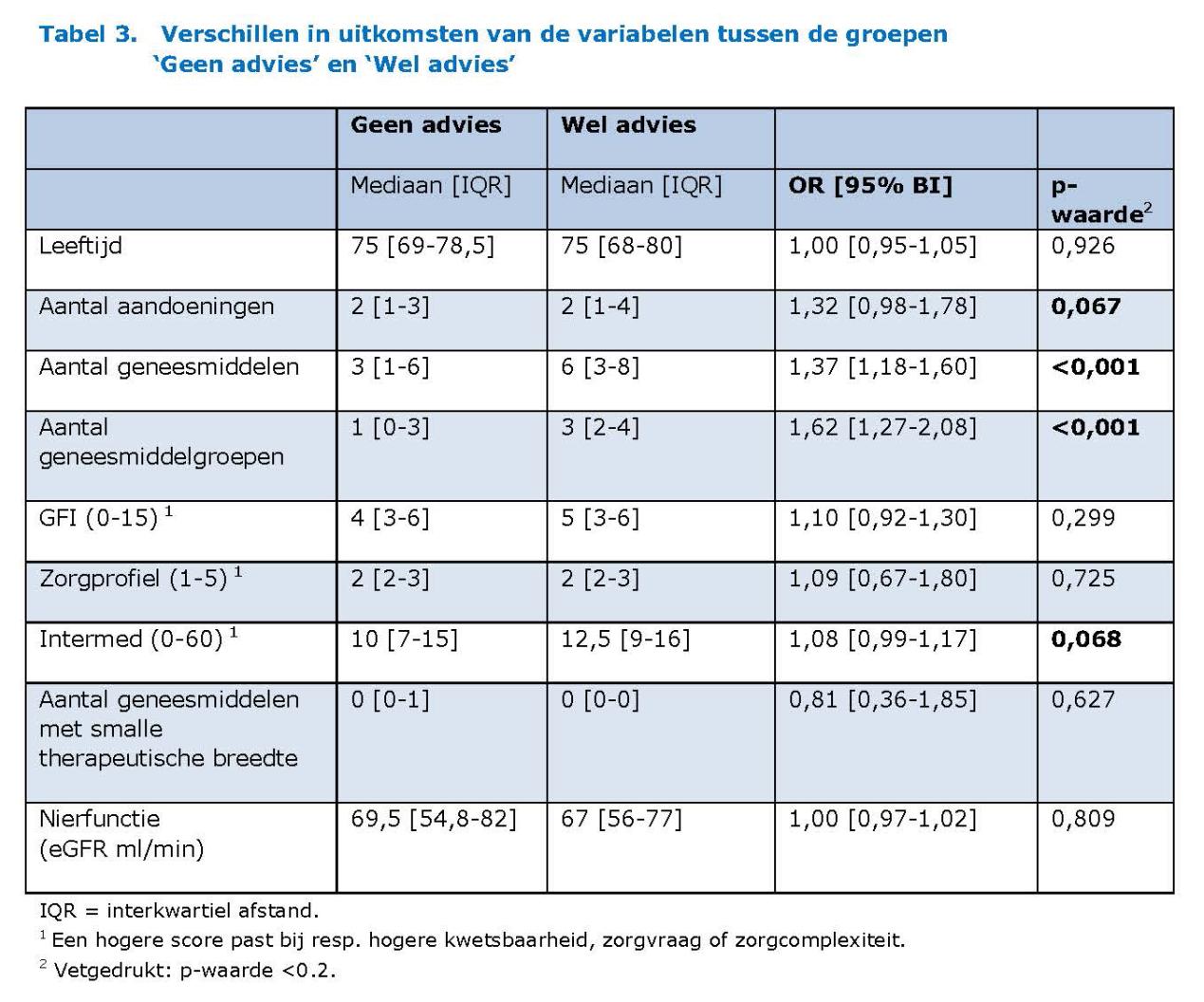
De variabelen ‘aantal aandoeningen’, ‘aantal geneesmiddelen’, ‘aantal geneesmiddelgroepen’ en Intermed werden univariaat voorgeselecteerd en meegenomen in de handmatige backward multivariate regressie analyse (zie tabel 3). Hieruit bleef alleen de variabele ‘aantal geneesmiddelen’ over in het eindmodel (OR 1.373 [95% BI 1.182 – 1.595], p =0.000). De Nagelkerke verklaarde variantie van dit model was 18,4%. In een ROC-curve met verschillende afkappunten voor aantal geneesmiddelen voor het voorspellen van het al dan niet geven van een advies bedroeg de AUC [95% BI] 0.736 [0.645 – 0.828] met als beste afkappunt 4. Bij dit afkappunt was de sensitiviteit 0.735 en de specificiteit 0.622.
Discussie
Uit dit onderzoek bleek dat aan 80% van de kwetsbare thuiswonende ouderen een of meerdere adviezen verstrekt worden na een medicatieanalyse en medicatiegesprek en dat 31% van de te controleren adviezen is doorgevoerd.
Uit de logistische regressie bleek dat het ‘aantal geneesmiddelen’ (met afkappunt van 4 of hoger) het beste voorspelde of er adviezen werden gegeven of niet. Deze resultaten laten zien dat, bij kwetsbare ouderen die meer dan drie medicijnen gebruiken, door medicatieveiligheidsscreening veel potentiële farmacotherapeutische problemen kunnen worden geïdentificeerd. Op slechts één derde van de geconstateerde problemen werd binnen zes maanden zichtbaar geanticipeerd. Het blijft dus van belang bij kwetsbare ouderen regelmatig opnieuw gestructureerd het medicatiegebruik te bespreken.
Richtlijn Polyfarmacie voor ouderen
In de richtlijn Polyfarmacie voor ouderen19 wordt aanbevolen regelmatig een medicatiebeoordeling te doen aan de hand van vijf stappen. In ons onderzoek is een deel van deze stappen gevolgd en is gemeten wat de effecten daarvan zijn. Een overzicht en vergelijking tussen de diverse stappen is te zien in tabel 4.
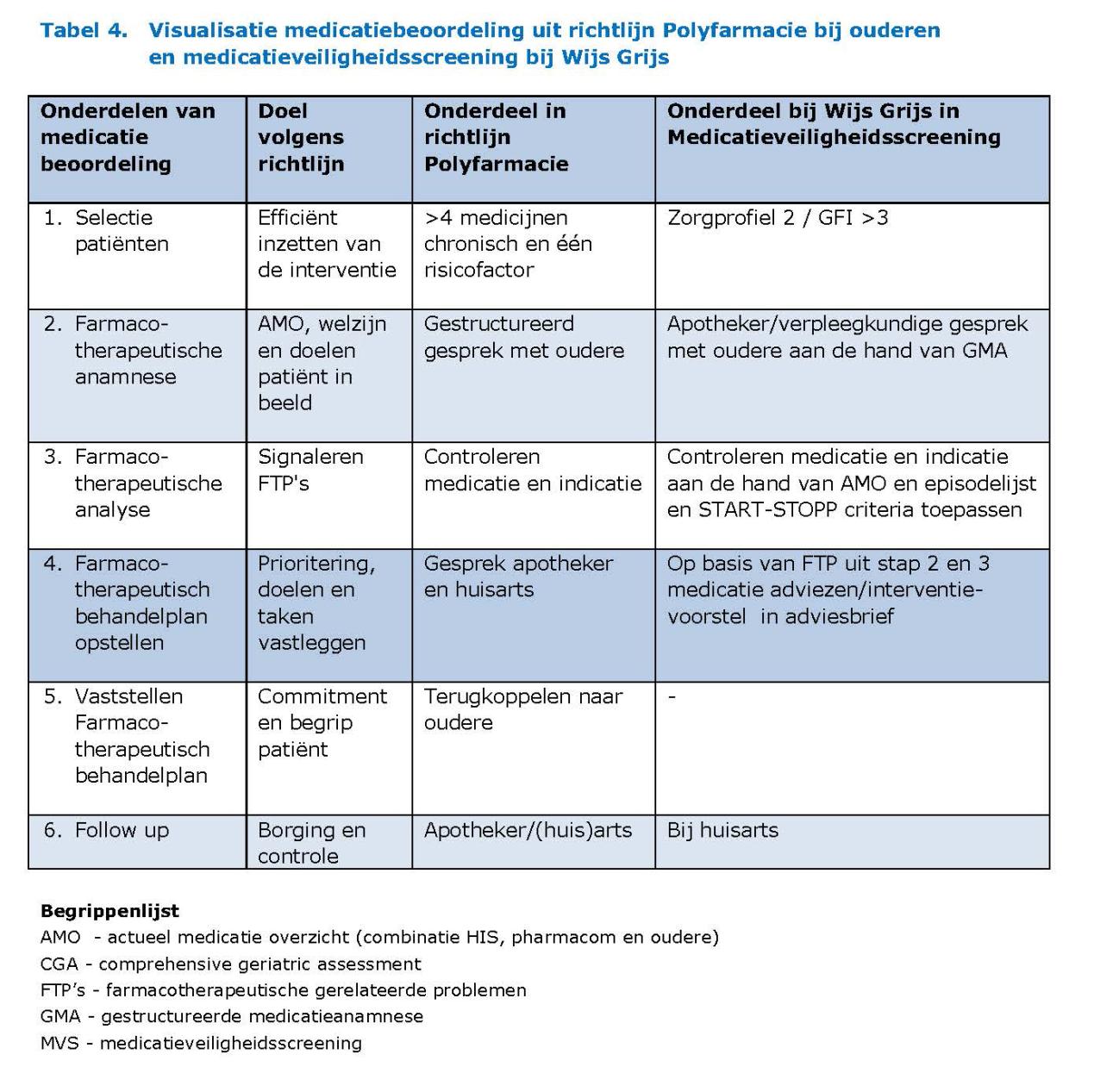
1. In de richtlijn vindt allereerst een selectie plaats voor het doen van een medicatiebeoordeling met als selectiecriteria polyfarmacie én een risicofactor (zoals verminderde nierfunctie). Voor een efficiënte tijdsinvestering zou men hiermee idealiter de groep ouderen selecteren met de meeste farmacotherapeutische problemen en dus de meeste te verstrekken adviezen. In ons onderzoek bleek deze selectie op de meeste verstrekte adviezen mogelijk op basis van polyfarmacie (≥4 geneesmiddelen) na screening op kwetsbaarheid (GFI ≥ 3 of zorgprofiel ≥2).
2. Het betrekken van de oudere bij dit gesprek is de tweede stap in de richtlijn. Een sterk punt van de opzet van de medicatieveiligheidsscreening is dat de adviezen werden gegeven naar aanleiding van een gesprek tussen de oudere zelf en een zorgverlener (apotheker of verpleegkundige). Het voeren van dit gesprek, door een andere hulpverlener dan de huisarts, kan een nieuw licht werpen op de problemen van de oudere, omdat de oudere dan meer blijkt te bespreken over het medicatiegebruik dan met de eigen huisarts.20
3-6. De volgende stap is het analyseren van de uitkomsten uit dit gesprek en de mogelijke FTP’s te signaleren. In de richtlijn wordt geadviseerd daarna in stap 4 een farmacotherapeutisch behandelplan op te stellen en dit in stap 5 met de oudere vast te stellen. Tussen apotheker en huisarts dient afgestemd te worden wie verantwoordelijk is voor het borgen van de uitvoering van de adviezen. Bij Wijs Grijs werd met de informatie uit de medicatieanamnese een farmacotherapeutische analyse verricht waarbij problemen gesignaleerd werden. Deze farmacotherapeutische problemen werden in adviezen omgezet en gecommuniceerd met de huisarts. De huisarts was eindverantwoordelijk voor het borgen van een goede medicamenteuze therapie. Er vond echter geen structureel contact met de huisarts plaats en er werd geen farmacotherapeutisch plan vastgesteld met de huisarts of oudere. Het ontbreken van deze afstemming kan een belangrijke belemmering zijn geweest in het uitvoeren van de adviezen. In een pilot onderzoek naar de mogelijkheden van implementatie van de richtlijn Polyfarmacie werden 73 van 133 (55%) voorstellen doorgevoerd, terwijl dit bij ons slechts één derde was.21
Een aanwijzing dat het knelpunt in het contact met de huisarts ligt, is dat in praktijken waarbij wel direct collegiaal – maar niet per se op casusniveau – contact met de huisarts is, het aantal doorgevoerde adviezen groter was. Daarnaast kan sprake zijn van adviezen die na overleg met de huisarts niet nodig bleken te zijn (omdat bijvoorbeeld niet het hele dossier bekend was bij de apotheker). Ondanks uitvoerige anamnese met de oudere, waarbij ook bereidheid tot aanpassing uitgevraagd werd, ontbrak het daadwerkelijk terugkoppelen van de medicatie-adviezen aan de oudere. Dit kan tot een belemmering leiden bij het uitvoeren van de adviezen. Wat opviel binnen het onderzoek was dat de adviezen ‘medicatie afbouwen’ en ‘medicatie stoppen’ het meest werden doorgevoerd, hoewel het stoppen van medicatie vaak moeilijker is dan het starten ervan omdat patiënten gehecht zijn aan hun medicatie.22 Het zou goed zijn om in een vervolgstudie te onderzoeken wat de achtergronden zijn van het feit dat sommige adviezen vaker doorgevoerd worden dan andere.
Ondanks de verschillen tussen de huidige medicatieveiligheidsscreening en de richtlijn Polyfarmacie voor ouderen werd een groot deel van de stappen gestructureerd doorlopen. Dit leverde veel gesignaleerde farmacotherapeutische problemen op.
Zwakke punten huidig onderzoek
Een zwak punt van de huidige onderzoeksopzet is dat een aantal adviezen niet werd meegenomen in de analyse omdat deze adviezen niet te verifiëren waren. Een alternatief had kunnen zijn om de nameting ook te verifiëren met de oudere en/of huisarts. Daarnaast is bij het ontbreken van een controlegroep niet uit te sluiten of medicatieveranderingen onafhankelijk van de MVS ook doorgevoerd zouden zijn.
Ten slotte werden alleen indirecte uitkomstmaten bepaald (gegeven en doorgevoerde adviezen), die gebaseerd waren op farmacotherapeutische problemen. Er zijn dus geen resultaten bekend op het niveau van directe uitkomsten als (vermijdbare) ziekenhuisopnames of valincidenten. Een valide intermediaire uitkomstmaat hiervoor zou zijn het beoordelen van ‘wel of geen potentieel onveilige situatie' met behulp van de Medication Appropriateness Index (MAI).23
Aanbeveling voor de praktijk
Om medicatieveiligheidsscreening effectiever in te zetten blijkt selectie op basis van het aantal geneesmiddelen mogelijk. Bij verbetermogelijkheden in het opvolgen van de gegeven adviezen zou gedacht kunnen worden aan het vergroten van de regie van de oudere, een structurele afstemming tussen arts en apotheker en een multidisciplinaire samenwerking waarbij de specialist ouderengeneeskunde – met expertise ten aanzien van het afwegen van behandeldoelen van de oudere - betrokken wordt.
Conclusie
In dit onderzoek zijn de uitkomsten weergegeven van de medicatieveiligheidsscreening, een combinatie van gestructureerde farmacotherapeutische anamnese en analyse om farmacotherapeutische problemen in kaart te brengen en (in de vorm van medicatieadviezen) aan de huisarts te rapporteren. Deze MVS levert veel punten van verbetering op voor het medicatiegebruik van de oudere. Aan 80% van de deelnemers werd adviezen gegeven na de MVS. Van de te verifiëren adviezen werd 31% doorgevoerd. Uit nader onderzoek dient achterhaald te worden waarom twee derde van de adviezen niet is doorgevoerd. Bij ouderen die vier of meer geneesmiddelen slikken werden significant vaker adviezen gegeven en vanuit dit oogpunt zouden de ouderen hierop vooraf geselecteerd kunnen worden voor deelname aan de MVS. Gezien het gegeven dat twee derde van de ouderen de adviezen niet opvolgt, lijkt het zeker van belang structurele afstemming tussen apotheker, huisarts en oudere te realiseren teneinde het aantal farmacotherapeutische problemen te verminderen.
Auteurs
- Ineke Bos, masterstudent geneeskunde, Rijksuniversiteit Groningen
- Drs. Wanda Rietkerk, aioto specialist ouderengeneeskunde, Gerion Amsterdam, UMCG Groningen
- Drs. Adriaan R.W. Barentsen: apotheker Apotheek Sûnenz te Drachten
- Prof. dr. Sytse U. Zuidema, hoofd sectie ouderengeneeskunde van de afdeling huisartsgeneeskunde, UMCG Groningen
Literatuur
- Hajjar ER, Cafiero AC, Hanlon JT. Polypharmacy in elderly patients. Am J Geriatr Pharmacother 2007 Dec;5(4):345-351.
- Van den Bemt P, Egberts A, Leendertse A. Hospital Admissions Related to Medication (HARM). Een prospectief, multicenter onderzoek naar geneesmiddel gerelateerde ziekenhuisopnames. Eindrapport. 2006.
- Walsh EK, Cussen K. "Take ten minutes": a dedicated ten minute medication review reduces polypharmacy in the elderly. Ir Med J 2010 Sep;103(8):236-238.
- Williams ME, Pulliam CC, Hunter R, Johnson TM, Owens JE, Kincaid J, et al. The short-term effect of interdisciplinary medication review on function and cost in ambulatory elderly people. J Am Geriatr Soc 2004 Jan;52(1):93-98.
- Zermansky AG, Petty DR, Raynor DK, Freemantle N, Vail A, Lowe CJ. Randomised controlled trial of clinical medication review by a pharmacist of elderly patients receiving repeat prescriptions in general practice. BMJ 2001 Dec 8;323(7325):1340-1343.
- Pit SW, Byles JE, Cockburn J. Medication review: patient selection and general practitioner's report of drug-related problems and actions taken in elderly Australians. J Am Geriatr Soc 2007 Jun;55(6):927-934.
- Vinks TH, Egberts TC, de Lange TM, de Koning FH. Pharmacist-based medication review reduces potential drug-related problems in the elderly: the SMOG controlled trial. Drugs Aging 2009;26(2):123-133.
- Lenaghan E, Holland R, Brooks A. Home-based medication review in a high risk elderly population in primary care--the POLYMED randomised controlled trial. Age Ageing 2007 May;36(3):292-297.
- Christensen M, Lundh A. Medication review in hospitalised patients to reduce morbidity and mortality. Cochrane Database Syst Rev 2013 Feb 28;2:CD008986.
- Allard J, Hebert R, Rioux M, Asselin J, Voyer L. Efficacy of a clinical medication review on the number of potentially inappropriate prescriptions prescribed for community-dwelling elderly people. CMAJ 2001 May 1;164(9):1291-1296.
- Krska J, Cromarty JA, Arris F, Jamieson D, Hansford D, Duffus PR, et al. Pharmacist-led medication review in patients over 65: a randomized, controlled trial in primary care. Age Ageing 2001 May;30(3):205-211.
- Kwint HF, Faber A, Gussekloo J, Bouvy ML. The contribution of patient interviews to the identification of drug-related problems in home medication review. J Clin Pharm Ther 2012 Dec;37(6):674-680.
- Teichert M, Luijben SN, Wereldsma A, Schalk T, Janssen J, Wensing M, et al. Implementation of medication reviews in community pharmacies and their effect on potentially inappropriate drug use in elderly patients. Int J Clin Pharm 2013 Oct;35(5):719-726.
- NHG. Comprehensive Geriatric Assessment for frail elderly in primary care. 2014; Available at: https://www.nhg.org/onderzoeken/comprehensive-geriatric-assessment-frail-elderly-primary-care-0.
- Olaroiu M, Ghinescu M, Naumov V, Brinza I, Heuvel W. The psychometric qualities of the Groningen Frailty Indicator in Romanian community-dwelling old citizens. Fam Pract 2014 Aug;31(4):490-495.
- Peters LL, Boter H, Buskens E, Slaets JP. Measurement properties of the Groningen Frailty Indicator in home-dwelling and institutionalized elderly people. J Am Med Dir Assoc 2012 Jul;13(6):546-551.
- Peters LL, Boter H, Slaets JP, Buskens E. Development and measurement properties of the self assessment version of the INTERMED for the elderly to assess case complexity. J Psychosom Res 2013 Jun;74(6):518-522.
- Eissens van der Laan MR, van Offenbeek MA, Broekhuis H, Slaets JP. A person-centred segmentation study in elderly care: towards efficient demand-driven care. Soc Sci Med 2014 Jul;113:68-76.
- Verduijn M, Leendertse A, Moeselaar A, de Wit N, van Marum R. Multidisciplinaire Richtlijn Polyfarmacie bij ouderen. 2013.
- Chen J, Britten N. 'Strong medicine': an analysis of pharmacist consultations in primary care. Fam Pract 2000 Dec;17(6):480-483.
- Van Balen J, Damen – van Beek, Z., Nelissen – Vrancken M, Verduijn M. Eindverslag Implementatie- en evaluatieproject Polyfarmacie bij ouderen.
- Anthierens S, Tansens A, Petrovic M, Christiaens T. Qualitative insights into general practitioners views on polypharmacy. BMC Fam Pract 2010 Sep 15;11:65-2296-11-65.
- Hanlon JT, Schmader KE, Samsa GP, Weinberger M, Uttech KM, Lewis IK, et al. A method for assessing drug therapy appropriateness. J Clin Epidemiol 1992 Oct;45(10):1045-1051.

